06 März 2020 |
La Revue POLYTECHNIQUE
Transmutation – Isotopes – Nombres magiques – Îlot de stabilité
Ils avaient pour ambition de transformer le plomb en or. Les alchimistes étaient à la recherche de la pierre philosophale, qui devait permettre la transmutation des métaux, la guérison des maladies et la quête de l’éternelle jeunesse. On peut les considérer comme des chercheurs engagés à la fois sur les chemins de la physique, de la chimie, de la métallurgique et de l’astronomique, mais aussi dans la quête de la perfection et du divin. La pratique de l’alchimie était accompagnée de spéculations philosophiques, mystiques ou spirituelles.
Les sources de l’alchimie remontent au IVe siècle av. J.-C. en Chine et au VIe siècle en Inde. En Occident, elle trouve ses sources en Égypte au début de notre ère, rencontre son heure de gloire au Moyen Âge ainsi qu’à la Renaissance, voire même au début de l’époque moderne. Les tentatives de transmutations des alchimistes reposaient sur les connaissances empiriques accumulées au fil des millénaires par les Mésopotamiens, les Égyptiens, les Grecs et les Chinois.
|
Roger Bacon (1212-1294) fut l’un des plus grands savants de son époque. Il portait un très grand intérêt aux recherches expérimentales et s’intéressait à la transmutation des métaux. |
La pierre philosophale
Le grand œuvre, c’est-à-dire la réalisation de la pierre philosophale, permettant la transmutation des métaux « vils », comme le plomb, en métaux « nobles », comme l’or et l’argent, était l’objectif des alchimistes. Il se basait sur l’idée de la fécondité des mines ; on pensait, en effet, que les filons et les minerais se transformaient et croissaient comme les végétaux.
Parmi les grandes figures de l’alchimie du Moyen Âge, on peut citer Gerber, (vers 720 à 800), qui découvrit un certain nombre de corps chimiques, dont l’eau régale, un mélange d’acide sulfurique et l’acide nitrique, l’une des rares substances pouvant dissoudre l’or. Albert le Grand (1193-1280), un évêque, savant et philosophe, descendait dans les mines pour connaître la substance des minéraux.
Roger Bacon (1212-1294), l’un des plus grands savants de son époque, portait un grand intérêt aux recherches expérimentales et s’intéressait à la transmutation des métaux. Arnaud de Villeneuve (1245-1313), alchimiste et philosophie, affirma que les astres jouaient un rôle essentiel dans le déroulement des expériences. Raymond Lulle (1235-1315) écrivit un grand nombre d’ouvrages traitant en particulier de la pierre philosophale.
Le médecin et philosophe suisse Paracelse (1493-1541) fut également un alchimiste. Il croyait en l’existence de l’alkaest, un élément à l’origine de tous les autres et qui était, selon lui, la pierre philosophale.
|
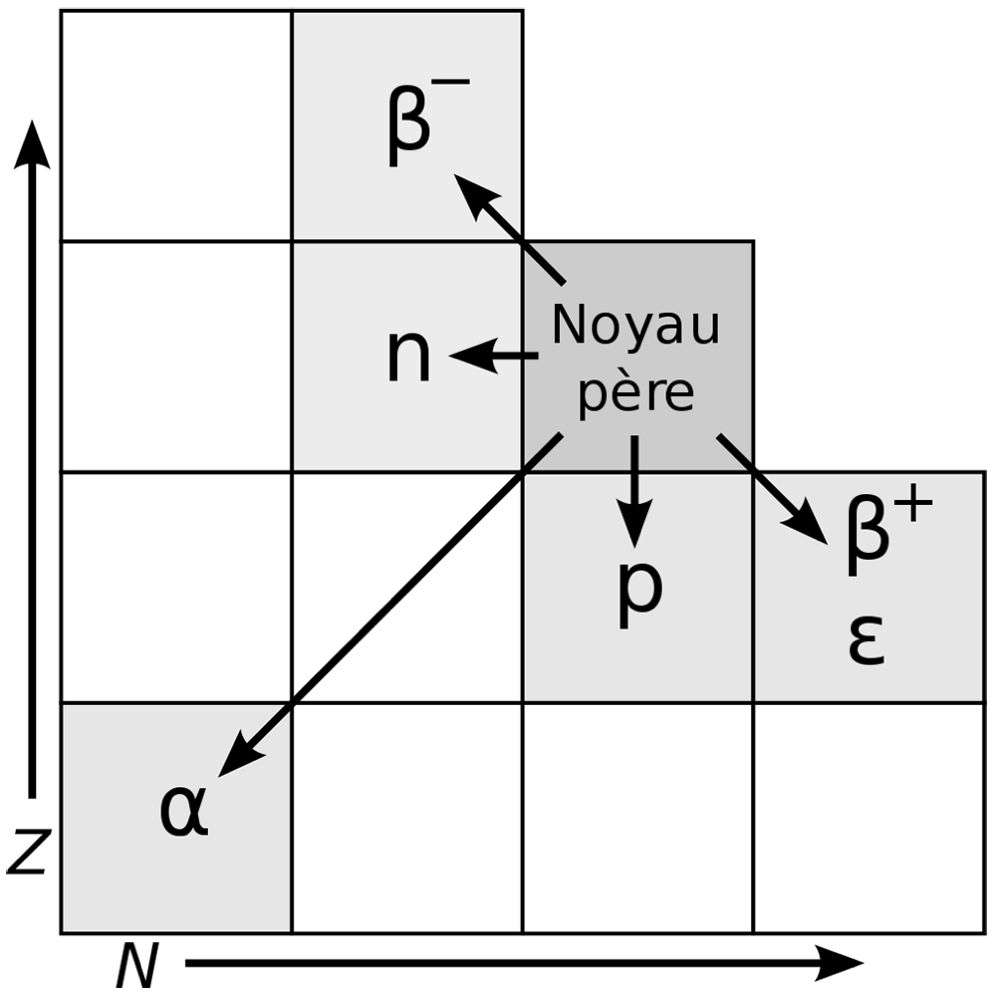
La désintégration radioactive engendre les rayons α, constitués de noyaux d’hélium, les rayons β, qui sont des électrons et les rayons γ, faits de photons, auxquels il faut ajouter les neutrons issus des fissions spontanées. |
Le déclin de l’alchimie
Aucun de ces savants et philosophes n’a pu, bien sûr, réussir la transmutation des métaux, même si certaines expériences ont pu le laisser croire. Ainsi, les alchimistes savaient extraire l’argent du minerai de plomb et comme le cuivre a des propriétés suffisamment proches de celles de l’or pour qu’on puisse les confondre, ils ont pu croire avoir trouvé la pierre philosophale.
Ce n’est qu’au cours du XVIIIe siècle que l’alchimie connut une phase de déclin, sans toutefois disparaître totalement, alors que la chimie moderne s’imposait avec les écrits de Descartes, qui nia que la matière renferme de l’esprit, puis les travaux de Lavoisier, souvent présenté comme le père de la chimie moderne. Au XIXe siècle, les quelques alchimistes toujours actifs étaient considérés comme des curiosités, vestiges d’une époque révolue. Au XXe siècle, avec le développement de la mécanique quantique, l’étude des noyaux atomiques a permis des progrès spectaculaires dans les applications de la physique nucléaire.
La transmutation
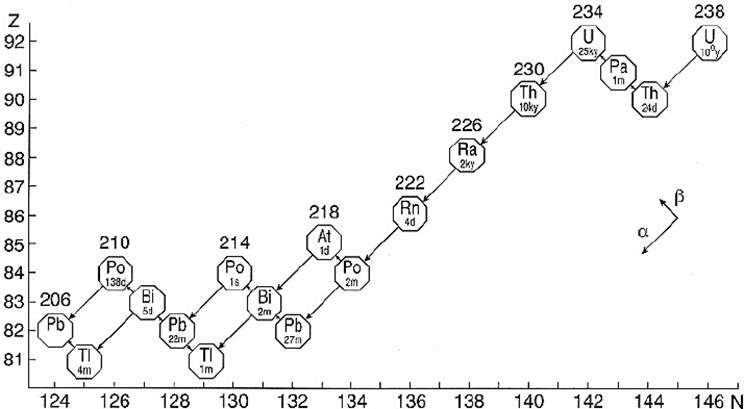
La transmutation est la transformation d’un élément chimique en un autre, par modification du noyau atomique. Elle peut se produire naturellement au cours d’une chaîne de désintégration ou être provoquée, dans les réacteurs nucléaires ou les accélérateurs de particules. Une chaîne de désintégration est une succession de désintégrations d’un radioisotope jusqu’à l’obtention d’un élément dont le noyau atomique est stable, généralement le plomb, élément le plus lourd possédant des isotopes stables.
Le plutonium 239 issus des réacteurs nucléaires, par exemple, se transforme en plomb à travers une chaîne de désintégration longue de plusieurs centaines de milliers d’années. C’est le phénomène de fission nucléaire, par lequel un noyau atomique lourd est scindé en nucléides plus légers. La fission de l’uranium 235 provoque une réaction en chaîne accompagnée de l’émission de neutrons et d’un dégagement d’énergie très important – de quelque 200 MeV par atome –, par rapport aux énergies des réactions chimiques qui sont de l’ordre de l’électronvolt.
|
Schéma de désintégration de l’uranium 238. La cascade aboutit au plomb 206, élément le plus lourd possédant des isotopes stables. |
La radioactivité - la force nucléaire faible
La radioactivité est un autre phénomène de transmutation, dans lequel des noyaux atomiques instables, les radioisotopes, se transforment spontanément en d’autres atomes en émettant des particules ainsi que de l’énergie. Elle a été découverte en 1896 par Henri Becquerel et très vite confirmée par Marie Curie.
On distingue les rayons α constitués de noyaux d’hélium, les rayons β, qui sont des électrons et les rayons γ, faits de photons, auxquels il faut ajouter les neutrons issus des fissions spontanées. L’énergie de ces particules est suffisante pour entraîner l’ionisation de la matière, d’où le nom de rayonnements ionisants.
C’est la force nucléaire faible ou interaction faible, qui est responsable de la désintégration radioactive de la plupart des particules, a fortiori des noyaux atomiques. Elle a été décrite pour la première fois dans les années 1930 par Enrico Fermi, qui s’en est servi pour expliquer la désintégration radioactive du neutron.
L’interaction faible est l’une des quatre forces fondamentales, à côté de la force nucléaire forte, de la force électromagnétique et de la gravitation. Elle est à l’origine de la fusion nucléaire dans les étoiles. Dans le modèle standard de la physique des particules, l’interaction faible est causée par l’échange de bosons W+, W- et Z0. Son effet le plus connu est la radioactivité β.
La radioactivité β
La radioactivité β est une désintégration au cours de laquelle un neutron est converti en un proton avec émission d’un électron (particule β) et d’un antineutrino. S’il s’agit de l’émission d’un positron, on parle de désintégration β+. L’électron peut également être capturé par le noyau. L’intensité de la radioactivité β est plus faible que celles des interactions électromagnétique et forte. C’est elle qui permet la datation par le carbone 14, en transformant celui-ci en azote 14.
La radioactivité α
La radioactivité α est une désintégration du noyau atomique au cours de laquelle un noyau d’hélium, appelé particule alpha, est éjecté. Il s’agit d’une forme de fission nucléaire où le noyau père se scinde en deux noyaux fils, dont l’un est un noyau d’hélium. Le noyau père se transforme en un nouvel élément de nombre de masse (somme du nombre de protons et du nombre de neutrons) diminué de quatre et de numéro atomique diminué de deux. Par exemple, le début de la désintégration de l’uranium 238 s’écrit : 238U —> 234Th + α.
La radioactivité γ
La radioactivité gamma est un rayonnement électromagnétique de courte longueur d’onde, donc très énergétique, qui se produit quand une désintégration ou la capture d’un neutron a laissé dans le noyau un trop plein d’énergie, qu’il perd en général très rapidement. Les désintégrations γ sont souvent produites en même temps que d’autres formes de radiations, telles que les désintégrations α et β.
Quand un noyau est dans un état excité, il redescend vers un niveau de moindre énergie en émettant un rayon γ, de la même façon qu’un électron émet un photon en redescendant d’un niveau d’énergie supérieur. Par exemple, le cobalt 60, qui est instable, se transforme par désintégration β en nickel 60 avec émission d’un antineutrino. Le nickel 60, dont le noyau est excité, retourne alors à l’état fondamental en émettant deux photons gamma :
60Co —> 60Ni* + e- + ν
puis : 60Ni* —> 60Ni + 2 γ
La capture électronique ou désintégration ε
Il s’agit d’un processus au cours duquel un noyau déficient en neutrons absorbe un électron situé sur une couche électronique. Il y a alors transmutation de l’atome puisqu’un proton, en absorbant l’électron, devient un neutron, avec émission d’un neutrino. L’atome qui avait Z protons et N neutrons devient un nouvel atome ayant (Z-1) protons et (N+1) neutrons.
Le rayonnement neutronique
Le rayonnement neutronique ou émission de neutron est la réaction par laquelle un isotope instable perd spontanément un neutron. Son nombre de masse diminue d’une unité, mais le numéro atomique est conservé, si bien qu’il n’y a pas transmutation. Par exemple 4H se transforme en 3H.
Le rayonnement neutronique est une forme de rayonnement ionisant qui peut se produire lors de la fusion ou de la fission nucléaire. Plus pénétrant que les rayonnements α ou β et même que les rayons γ, il est utilisé pour l’analyse métallographique, ainsi qu’en biologie et en médecine.
La radioactivité de proton ou émission de proton
C’est une désintégration radioactive dans laquelle un proton est éjecté du noyau atomique depuis un état d’énergie très excité ou lors d’une décroissance radioactive de noyaux très déficients en neutrons, consécutivement à une désintégration β+ dans des noyaux exotiques.
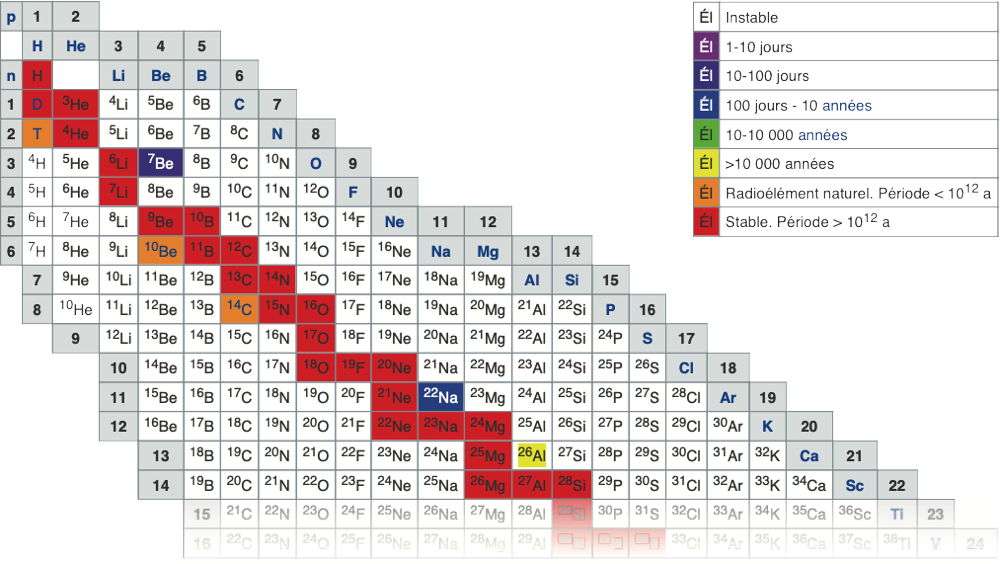
|
Cette figure représente la partie supérieure du tableau répertoriant tous les isotopes connus, ordonnés selon leur numéro atomique croissant de gauche à droite et avec un nombre croissant de neutrons de haut en bas. Les éléments stables (en rouge) forment la vallée de la stabilité. Le tableau complet figure sur le lien https://fr.wikipedia.org/wiki/Table_des_isotopes. |
Les isotopes
Les différents arrangements de protons, de neutrons et d’électrons formant les 118 éléments du tableau périodique forment ce que l’on appelle des isotopes. Les isotopes d’un élément sont des noyaux ayant le même nombre de protons (Z) – caractéristique de cet élément –, mais un nombre de neutrons différent (N). On connaît actuellement 325 isotopes naturels et quelque 1200 isotopes créés artificiellement.
Quatre-vingt éléments chimiques, allant de l’hydrogène 1H au plomb 82Pb, ont au moins un isotope stable. Le technétium 43Tc, le prométhium 61Pm, ainsi que tous les éléments de numéro atomique supérieur à 83 n’ont, quant à eux, aucun isotope stable. Un nucléide stable se définit comme ayant une demi-vie au moins égale à 1012 ans.
Les isotopes d’un même élément ont les mêmes caractéristiques physiques et chimiques. La différence de masse entre isotopes entraîne cependant de légères différences de propriétés, appelées effets isotopiques. Ce qui permet, par exemple, d’enrichir l’uranium naturel en 235U par diffusion thermique, diffusion gazeuse, centrifugation ou séparation électromagnétique.
La proportion de l’isotope stable par rapport à l’isotope instable est la même dans l’atmosphère et dans les tissus des êtres vivants, mais elle varie au cours du temps. C’est sur cette variation que se base la plus connue des méthodes de datation radioactive, celle du carbone 14.
L’uranium 238 (238U), le thorium 232 (232Th) et le potassium 40 (40K) sont les radioisotopes les plus fréquents dans les roches terrestres. Outre ces isotopes radioactifs naturels, il en existe dans la nature de beaucoup plus rares, comme ceux du radium et du radon.
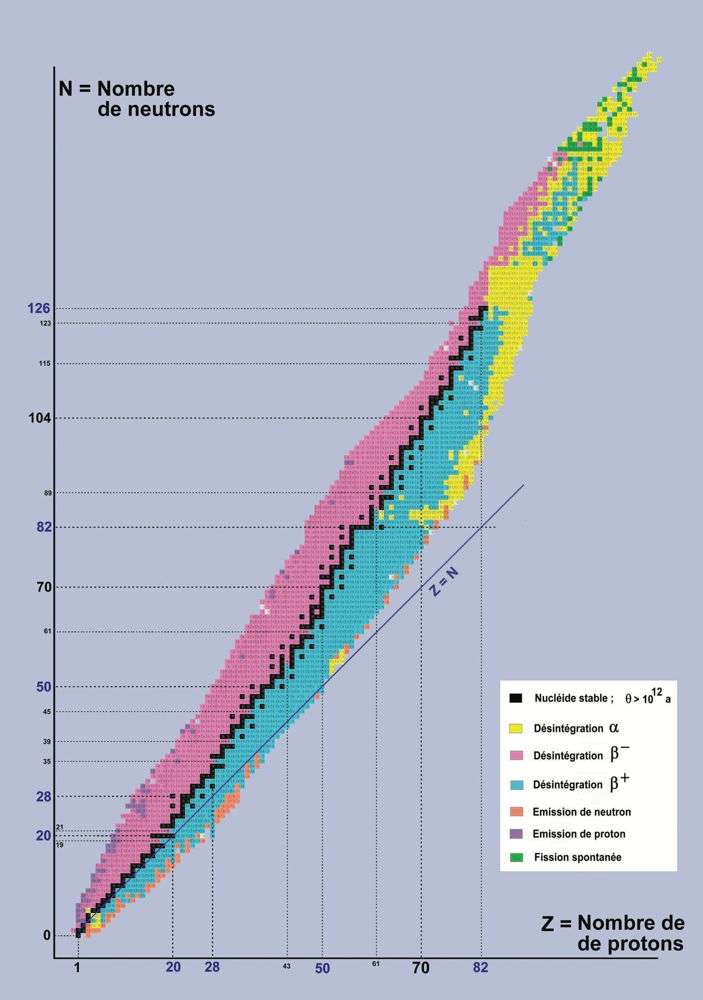
|
Carte des nucléides par type de désintégration. Les zones rose et bleue figurent des nucléides instables, séparées par la ligne noire des nucléides stables. Les nombres magiques de neutrons et de protons sont repérés suivant les marches d’escalier de la courbe noire (2, 8, 20, 28, 50, 82 et 126). |
Les nombres magiques
Certains noyaux particulièrement stables contiennent des protons ou des neutrons en nombre égal à des « nombres magiques ». Il y en a sept : 2 (correspondant au remplissage de la première couche), 8 (deux premières couches pleines), 20 (trois premières couches remplies), 28, 50, 82 et 126 Une approche théorique montre que 184 pourrait être le huitième nombre magique. Ces valeurs correspondent à des noyaux possédant des couches complètes de neutrons ou de protons, qui leur confèrent une très grande stabilité. L’oxygène et le calcium en sont deux exemples. Le modèle en couches décrivant la structure nucléaire est basé sur une stratification des nucléons en niveaux d’énergie dans le noyau, à l’instar de ce qui se passe pour les électrons au niveau de l’atome.
Lorsque les nombres de protons et de neutrons d’un noyau appartiennent tous deux à un nombre magique, celui-ci devient « doublement magique ». Il est, par conséquent extrêmement stable. C’est le cas notamment de l’hélium, qui comporte deux protons et deux neutrons, de l’oxygène (huit protons et huit neutrons) ou du plomb (82 protons et 126 neutrons), le plus lourd des noyaux stables connus à ce jour.
L’îlot de stabilité
Certaines théories prévoient l’existence d’un groupe de nucléides transuraniens qui présenteraient une période radioactive très supérieure à celle des isotopes voisins. Appelé « îlot de stabilité », cette zone renfermerait des noyaux superlourds régis par des nombres doublement magiques, qui seraient remarquablement stables en dépit de leur masse très élevée. L’organesson, l’élément le plus lourd connu à ce jour, dont la période radioactive est de 0,89 ms, se situerait dans le voisinage de cet îlot de stabilité.
Les premiers éléments de la famille des superactinides, jusqu’à Z ≈ 130, pourraient avoir des isotopes plus stables que les autres nucléides superlourds, avec des périodes radioactives atteignant quelques secondes. Selon la théorie, un îlot de stabilité pourrait exister autour de l’unbihexium 310, un élément hypothétique de numéro atomique 126, qui comporterait 126 protons et 184 neutrons. Cet élément de la 8e période du tableau périodique appartiendrait à la famille des superactinides. Des synthèses de l’unbihexium tentées au CERN n’ont, jusqu’à aujourd’hui, pas abouti. Il faut dire que ces noyaux superlourds sont des systèmes quantiques extrêmement complexes.
Étant proche de l’îlot de stabilité, l’unbiquadium, l’élément 124, comportant 124 protons et 206 neutrons, pourrait avoir des isotopes particulièrement stables, avec des périodes radioactives se chiffrant peut-être en secondes. Il fait partie des éléments qu’il pourrait être possible de produire avec les techniques actuelles.
Il n’est toutefois pas certain que l’existence d’atomes aussi lourds soit possible, la répulsion électrostatique d’un nombre trop important de protons dans un même noyau pouvant induire une fission spontanée avec transmutation vers des numéros atomiques inférieurs.
|
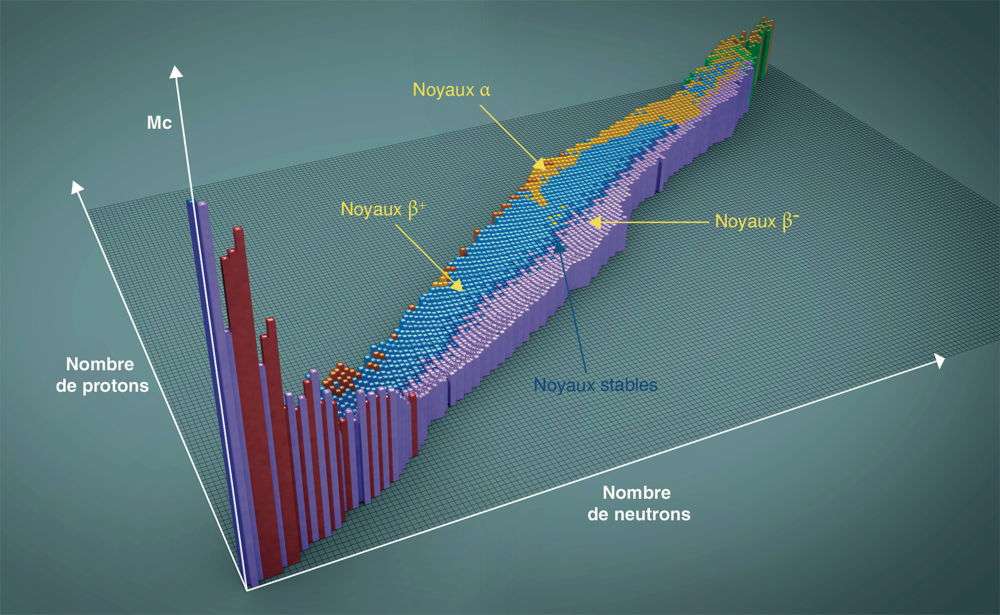
L’ensemble des isotopes forme le diagramme de la vallée de la stabilité où ils sont classés en fonction de leur nombre de protons, de neutrons et de l’énergie de liaison du noyau (Mc).(© cea)
|
La vallée de la stabilité
Lorsqu’on classe les noyaux des atomes en fonction de leur nombre de protons (Z) et de neutrons (N), on obtient un ensemble de données en forme de faisceau. Si l’on ajoute la valeur de l’énergie de liaison de chaque noyau sous la forme d’un histogramme, on obtient un graphe en trois dimensions qui présente une surprenante vallée au fond de laquelle se situent les 291 atomes stables connus. Plus on s’éloigne de ces noyaux, plus l’énergie de liaison des nucléons est faible. De part et d’autre de la vallée se trouvent les noyaux instables qui « dévalent la pente » en subissant des désintégrations, jusqu’à rejoindre la vallée de la stabilité. Les atomes radioactifs subissent une série de transformations qui les ramène toujours vers le fond de la vallée.
Sur le flanc des noyaux riches en neutrons, par exemple, le césium 143 subit cinq transformations successives qui le transforment en néodyme 143, stable. De l’autre côté de la vallée, le carbone 14, riche en protons, subit une désintégration β qui le transforme en azote 14, stable lui aussi.
|
Les règles de l’alchimie
Les règles de l’alchimie ont été édictées par Albert le Grand, maître de l’Université de Paris (vers 1193-1280). Elles se résument ainsi :
-
L’alchimiste sera discret et silencieux. Il ne révélera à personne le résultat de ses opérations.
-
Il habitera loin des hommes, une maison dans laquelle il y a aura deux ou trois pièces exclusivement destinées à ses recherches.
-
Il choisira les heures et le temps de son travail.
-
Il sera patient, assidu, persévérant.
-
Il exécutera d’après les règles de l’art, les opérations nécessaires.
-
Il ne se servira que de récipients en verre ou en poterie vernissée.
-
Il sera assez riche pour faire en toute indépendance les dépenses qu’exigent ses recherches.
-
Il évitera d’avoir des rapports avec les princes et les seigneurs.
|
|
La période radioactive
La période radioactive ou demi-vie d’un isotope est le temps nécessaire pour que la moitié de ses noyaux se désintègrent naturellement. Il s’agit d’une décroissance exponentielle qui peut varier considérablement d’un isotope à l’autre. La plus courte demi-vie jamais observée est celle de l’hydrogène 7, (2,3 x 10−27 s) et la plus longue, celle du xénon 124, (1,8 x 1022 ans, soit 1300 milliards de fois l’âge de l’Univers.
|
|
Les superactinides
La famille des superactinides contiendrait les éléments hypothétiques de numéro atomique 121 à 153. L’existence de cette famille avait été conjecturée par Glenn Seaborg, lauréat du Prix Nobel de chimie 1951. Elle n’est pas reconnue par l’Union internationale de chimie pure et appliquée (UICPA). Il n’est, en effet, pas certain que l’existence d’atomes aussi lourds soit possible, la répulsion électrostatique d’un nombre trop important de protons dans un même noyau pouvant induire une fission spontanée. D’autres considérations amènent à envisager la limite physique du numéro atomique à des niveaux bien inférieurs, ne dépassant pas Z = 130, juste au-delà de l’hypothétique îlot de stabilité. |


 Abonnements
Abonnements