Remplacement des électrolytes cyanurés en galvanoplastie 🔊
Quentin Orecchioni, Marie-Pierre Gigandet, Jean-Yves Hihn | Institut Utinam, université Marie et Louis Pasteur, Besançon, France
Les cyanures sont des composés ayant un fort pouvoir complexant, permettant notamment d’abaisser le potentiel des métaux nobles en solution pour une utilisation en galvanoplastie. Bien qu’ils soient très répandus dans les ateliers de traitement de surface, leur utilisation est aujourd’hui remise en question. En effet, en plus de la dangerosité que présentent ces électrolytes, ils complexifient les étapes de traitement des effluents et présentent des risques et des inconvénients règlementaires quant à leur stockage. Ainsi, le développement de solutions alternatives pour les procédés cyanurés suscite-t-il un réel intérêt industriel.
L’utilisation des cyanures dans le traitement de surface
Dans le langage courant, le terme cyanure est souvent lié à une intoxication par un composé toxique. Or, si cela est vrai lorsque ce composé se trouve sous la forme de cyanure d’hydrogène gazeux, de cyanure de potassium ou de cyanure de sodium, celui que l’on utilise dans les entreprises de galvanoplastie est une forme bien différente... quoique... Les électrolytes cyanurés sont très répandus pour la galvanoplastie de métaux nobles, tels que le cuivre, l’argent et l’or. En effet, ces métaux ayant un potentiel standard élevé, ils forment avec les cyanures des complexes dont le potentiel est significativement abaissé. Ce phénomène permet de réduire les phénomènes de dépôt spontané à la surface d’un métal moins noble, phénomène dit « par déplacement » du métal en solution sur le substrat (généralement du laiton ou une sous-couche de nickel). L’exemple ci-dessous montre le potentiel du couple d’argent obtenu à partir d’un sel (nitrate, sulfate, sulfamate...).
En solution se trouve la forme ionisée Ag+, qui sera réduite par le substrat de nickel, qui est le métal moins noble sous sa forme métallique. Si les ions argent sont complexés par des cyanures, leur potentiel est bien plus bas que celui du couple Ni2+/Ni, et le dépôt n’aura lieu qu’avec l’aide d’un générateur. En plus de leur effet sur le potentiel d’oxydo-réduction, la présence de cyanures confère une grande stabilité à l’électrolyte, grâce aux constantes de formation très élevées des complexes formés avec les métaux, largement supérieures à celles de la plupart des autres ligands. On notera que, pour un même métal, plusieurs complexes cyanurés sont possibles, en fonction des rapports concentration métal sur cyanures (M+ /CN-). Dans les procédés de galvanoplastie, un excès de cyanure dit « libre » est ajouté, afin de maintenir l’équilibre en faveur de la formation du ou des complexes cyanurés.
D’un point de vue plus pratique, les sels métalliques cyanurés de cuivre, d’argent et d’or sont relativement bon marché, leur fabrication étant plutôt aisée.
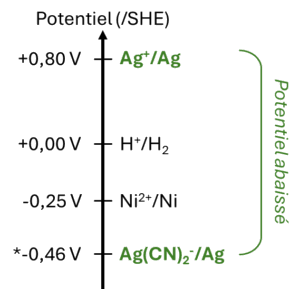
Figure 1. Échelle des potentiels standards d’oxydoréduction de différents couples.
(*) valeur donnée à titre indicatif à une concentration arbitraire.
| Ligand | Ion métallique | Log(K1) | Log(K2) | Log(K3) | Log(K4) |
| Cyanure | Cu (I) | 24,0 | 28,6 | 30,3 | |
| Ag (I) | 21,1 | 21,7 | 21,1 | ||
| Au (I) | 38,3 | ||||
| Pyrophosphate | Cu (II) | 6,7 | 9,0 | ||
| Thiosulfate | Ag(I) | 8,82 | 13,46 | ||
| Bromure | Au(I) | 12,46 |
Table 1. Constantes de formation de différents complexes avec le cuivre, l’argent et l’or
Désavantages liés à l’utilisation de cyanures
La toxicité des cyanures n’est plus à établir ; que ce soit pour une exposition aiguë ou chronique, leur présence dans l’organisme entraîne de graves complications. Cependant, dans un contexte industriel où le risque d’ingestion reste faible, le principal danger des composés cyanurés est la formation de cyanures libres. Au risque d’accident avec, par exemple, le cyanure d’hydrogène – un gaz toxique létal formé par l’action d’un acide sur un cyanure alcalin –, s’ajoutent les effets critiques sur la santé découlant d’une exposition chronique (à long terme) aux cyanures libre/simple (HCN et NaCN), avec des effets sur la thyroïde et le système reproducteur masculin. La plupart de ces bains fonctionnent donc en milieu basique et ne doivent pas entrer en contact avec des acides. Néanmoins, la séparation des lignes de traitement cyanurées et acides fait que, dans la pratique, le risque de formation de cyanure d’hydrogène est bien maîtrisé par les applicateurs.
D’autre part, l’utilisation de procédés cyanurés en galvanoplastie implique d’oxyder les cyanures avant leur rejet, avec un traitement des effluents dédiés. Cela implique des charges supplémentaires avec des espaces dédiés, l’entretien et le contrôle du procédé de décyanuration, les réactifs utilisés présentant eux-mêmes des risques. Devant l’usage de l’ozone ou de l’eau oxygénée, l’hypochlorite de sodium reste l’oxydant le plus courant. Au regard de ces risques, la réglementation concernant les cyanures incite les industriels à limiter leur utilisation. Plus particulièrement, une quantité de cyanure allant au-delà d’un certain seuil sur un même site, peut entraîner son classement en ICPE (Installations classées pour la protection de l’environnement) et selon la directive SEVESO. La règlementation ICPE concerne les activités ou stockages pouvant générer des nuisances ou des risques pour l’environnement et la population riveraine, très contraignants pour le fonctionnement quotidien de l’ensemble du site. Sont particulièrement visées les activités de cuivrage et d’argentage pouvant utiliser de grands volumes de bain.
L’ensemble de ces arguments plaide en faveur du développement d’électrolytes alternatifs non cyanurés.
Quelles solutions de remplacement ?
La très large majorité des électrolytes industriels pour la dorure utilise des complexes d’aurocyanure de potassium K[Au(CN)2] [1-3]. L’or est si fortement complexé, qu’il est stable et utilisable jusqu’à un pH 3. Cela a permis le développement de formulations acides pour des revêtements d’or faiblement alliés, neutres pour ceux en or pur, et alcalins dans le cas de revêtements fortement alliés. Compte tenu du prix de ce métal, les volumes de bains utilisés sont faibles, comparés à ceux de cuivre ou d’argent. Ainsi, le remplacement des cyanures dans les procédés de dorage n’est pas motivé par une contrainte réglementaire, mais plutôt par un souci d’image de marque des donneurs d’ordres. Des solutions ont été proposées en complexant l’or à partir de sels à base de chlorures ou de sulfites. L’aurosulfite [Au(SO3)2]3-, connu depuis 1842, est encore à ce jour le plus utilisé des complexants pour la formulation de bains non cyanurés pour la dorure [4]. Cependant, ils sont bien moins stables que ceux utilisant des cyanures, parce que leur protonation survient en milieu acide, et ils deviennent facilement oxydables. Pour remédier à cette instabilité, des bains sans cyanures à base de sulfites ou de thiosulfites sont souvent utilisés à un pH ≥ 6 [5-9], mais dans ce cas, les bains doivent être stabilisés avec des complexants secondaires, comme des citrates [10], des polyphénols [11], des polyamines [12] ou des thiocarbamides [13].
Tous ces aspects rendent difficile la production constante d’une teinte pour une application décorative, par exemple. Problématique qui a été investiguée par l’Institut UTINAM dans le cadre du projet d’Innovation Stratégique Industrielle (ISI) MOMEQA de la Banque Publique d’investissement, impliquant de 2013 à 2018 huit partenaires industriels, ainsi que des académiques. BPI France, avec l’utilisation de solutions commerciales (figure 2) ou le développement de solutions innovantes avec une nouvelle teinte donnant un aspect patiné (figures 3) [14].

Figure 2. Carrure de montre en inox revêtue d’or par un procédé exempt de cyanure – revêtement réalisé par UTINAM avec un électrolyte AURIUM 298 Coventya.

Figure 3. Carrure de montre en inox revêtue d’or par un procédé exempt de cyanure – revêtement réalisé par UTINAM avec un électrolyte VINTAGE GOLD.
Les bains de cuivrage alcalin cyanurés ont toujours coexisté aux cotés des bains au sulfate acide. En effet, ces deux électrolytes couvrent des applications différentes : là où les électrolytes alcalins permettent d’obtenir un pouvoir de répartition très élevé et sont recommandés pour le traitement d’aciers et d’alliages de zinc, les bains acides donnent des revêtements brillants et à forte vitesse de déposition. Ainsi, le remplacement des cyanures dans le cas du cuivrage concerne uniquement les premières applications. Des solutions utilisant les pyrophosphates comme ligands sont utilisées dans l’industrie, mais avec des performances en retrait par rapport aux bains cyanurés, notamment pour le traitement des alliages de zinc. De plus, l’incorporation de phosphore dans les revêtements reste un point possiblement problématique pour certaines applications. Des investigations récentes concernent des laitons électrodéposés [15].
Dans les années 70 apparaissent les premières formulations d’argent sans cyanure utilisant des thiosulfates comme complexant. Cependant, ces électrolytes n’ont jamais connu de réelles applications industrielles en raison de leur sensibilité à la lumière. Depuis, plusieurs solutions de remplacement ont été proposées, utilisant de la thiourée, de l’EDTA, de l’acétate, de l’uracile ou encore des hydantoïnes. Bien que les solutions utilisant la thiourée soient prometteuses, le classement de cette molécule comme cancérigène avéré empêche son déploiement industriel [16]. Aujourd’hui, l’utilisation d’hétérocycles azotés dans les bains d’argentage sans cyanure semble être la meilleure option, en partie due à leur faible toxicité. Parmi eux, la 5,5-dimethylhydantoïne, connue pour son pouvoir chélatant sur les métaux, [17] a une grande affinité avec l’argent pour former des complexes [Ag(DMH)2]- en milieu alcalin. Ainsi, plusieurs publications et brevets concernant des bains d’argentage non cyanurés utilisant de la 5,5-diméthylhydantoïne ont vu le jour depuis le début des années 2010 [18]. Néanmoins, obtenir un revêtement aussi performant qu’à partir d’un bain cyanuré peut s’avérer complexe et nécessiter l’ajout de nombreux composés (co-complexants, tensioactifs, durcisseurs, affineurs de grains, etc.), parfois eux-mêmes toxiques.
Face à l’électrification croissante des moyens de transport et aux cahiers des charges de plus en plus exigeants du secteur industriel associé, les revêtements d’argent purs, notamment issus de bains non cyanurés, peinent à atteindre les performances attendues. Une stratégie face à cette problématique peut consister à allier l’argent avec un élément lui permettant d’augmenter significativement ses propriétés. Parmi les différents alliages possibles, l’argent-tungstène suscite un réel intérêt industriel pour des applications dans le domaine de la connectique. En effet, la forte conductivité de l’argent associée aux bonnes propriétés mécaniques du tungstène permet d’obtenir des alliages à la fois performants et résistants, notamment à l’abrasion. Le dépôt récent de plusieurs brevets au sujet des revêtements Ag-W sans cyanure, ainsi que la mise en application de ces procédés sur certains sites industriels, sont autant de facteurs qui soulignent le potentiel de cet alliage dans le domaine de la connectique. C’est dans ce contexte qu’est né le projet SILAHPERF (SILver Alloys High PERFormances), mené conjointement par l’IRT-M2P et l’institut UTINAM, et dont le but est d’explorer les mécanismes de codéposition de plusieurs alliages d’intérêt, avec un accent particulier sur l’argent-tungstène en recherchant des solutions respectueuses de l’environnement par un travail spécifique sur les paramètres de l’électrolyse. [19] Aujourd’hui des solutions prometteuses sont étudiées à l’échelle du laboratoire et les échantillons produits présentent des propriétés physico-chimiques intéressantes.


Figure 4. Revêtement d’argent-tungstène sur un substrat cuivre obtenu à partir d’une solution sans cyanure développée au laboratoire UTINAM (à gauche) et revêtement d’argent pur obtenu par la même formulation (à droite).
Références :
1. M. Viswanathan, Ch. J. Raub, Surf. Technol., 4, 339–342 (1976).
2. B. Bozzini, P. L. Cavallotti, J. Appl. Electrochem., 31, 897–903 (2001).
3. S. Valizadeh, E. B. Svedberg, P. Leisner, J. Appl. Electrochem., 32, 97–104 (2002).
4. Kai Wang, R. Beica, N. Brown, in IEEE/CPMT/SEMI 29th International Electronics Manufacturing Technology Symposium (IEEE Cat. No.04CH37585), p. 242–246, IEEE,
San Jose, CA, USA (2004).
5. M. J. Liew, S. Roy, K. Scott, Green Chem., 5, 376 (2003).
6. T. A. Green, M.-J. Liew, S. Roy, J. Electrochem. Soc., 150, C104 (2003).
7. J. J. Kelly, N. Yang, T. Headley, J. Hachman, J. Electrochem. Soc., 150, C445 (2003).
8. K. Oyaizu et al., Inorg. Chem., 44, 6915–6917 (2005).
9. T. Osaka, Y. Okinaka, J. Sasano, M. Kato, Sci. Technol. Adv. Mater., 7, 425–437 (2006).
10. A. He, Q. Liu, D. G. Ivey, J. Mater. Sci. Mater. Electron., 20, 543–550 (2009).
11. Y. Ohtani, A. Horiuchi, A. Yamaguchi, K. Oyaizu, M. Yuasa, J. Electrochem. Soc., 153, C63 (2006).
12. X. Ren et al., RSC Adv., 5, 64806–64813 (2015).
13. R. Yu. Bek, O. N. Shevtsova, Russ. J. Electrochem., 46, 312–318 (2010).
14. J. Schoenleber, J-Y Hihn, M-P Gigandet, J Husson Patent n° : WO2023174871. (2023).
15. A Dridi, L Dhouibi, J-Y Hihn, P Berçot, W Sassi, E. M. Rezrazi, J. Electrochem. Soc., 167 062508 (2020)
16. Safety Data Sheet Sigma-Alrich Thiourea CAS n° 66-56-6, (n.d.)
17. G.Z. Pavlovich, R.G. Luthy, Complexation of metals with hydantoins, Water Res. 22 (1988) 327–336
18. A. Liu, X. Ren, J. Zhang, G. Yuan, P. Yang, J. Zhang, M. An, A composite additive used for an excellent new cyanide-free silver plating bath, New J. Chem. 39 (2015) 2409–2412
19. Q. Orecchioni, M-P Gigandet, A. Krystianiak,
À propos de l’UNITAM
L’institut UTINAM est une unité mixte de recherche de l’université Marie et Louis Pasteur et du CNRS à Besançon. L’équipe SRS est composée d’une vingtaine de personnes (enseignants-chercheurs, ingénieurs, techniciens, doctorants et post-doctorants) travaillant dans les domaines de l’électrochimie et des traitements de surface. L’Association de Traitement Thermique et de Traitement de Surface (A3TS) compte environ 800 adhérents, qui sont des sociétés, des organismes industriels français et internationaux, des ingénieurs, chercheurs, experts et universitaires. Son objectif est de diffuser et de promouvoir le savoir technologique de pointe dans les domaines du traitement des matériaux. L’IRT M2P met son expertise, ses équipements et son réseau de laboratoires académiques au service des projets de R&D avec une offre de technologies ainsi qu’avec les plateformes qui sont au service de tout industriel au travers de prestations sur mesure, de R&D privée ou multipartenaires avec un cofinancement privé/public.
Contact
Jean-Yves HIHN
Université Marie et Louis Pasteur CNRS UMR 6213
UTINAM 16 route de Gray
F-25030 Besançon
A3TS 71 rue Lafayette
F-75009
Paris
IRT M2P www.irt-m2p.fr


 Des abonnements
Des abonnements




