| Amedeo Avogadro (1776-1856) était un physicien et chimiste italien qui présenta en 1811, le véritable concept de molécule, en le distinguant clairement de celui d'atome. |
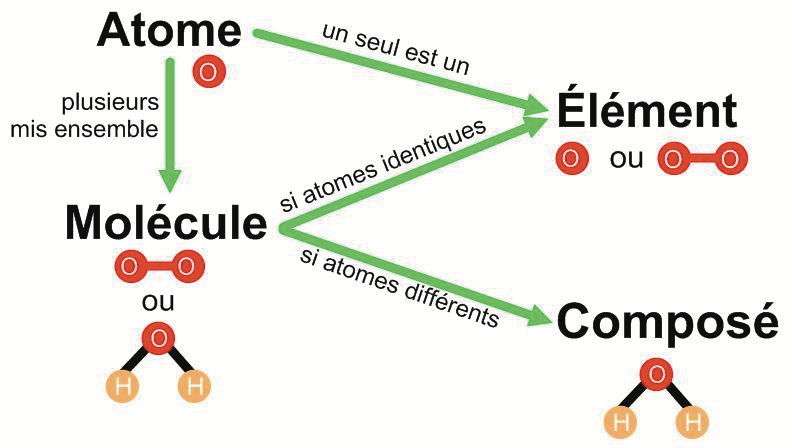
Une entité électriquement neutre comprenant plus d'un atome
L'Union internationale de chimie pure et appliquée (UICPA) définit la molécule comme étant une entité électriquement neutre comprenant plus d'un atome. Son nom vient du latin molecula, qui signifie « masse ». Tout comme l'atome, la molécule représente la plus petite quantité de matière possédant les propriétés caractéristiques d'une substance.
Tous les éléments naturels du tableau périodique – y compris les gaz inertes, ainsi que plusieurs éléments synthétiques transuraniens –, sont capables de se combiner avec d'autres pour former des molécules. Récemment, par exemple, une équipe internationale a mis en évidence un nouveau composé du plutonium, PuO22+, dont la stabilité, qui atteint plusieurs mois, est surprenante. Une autre équipe vient de découvrir, dans l'espace interstellaire, de l'hydrure d'hélium, un composé considéré comme la première liaison moléculaire à s'être créée dans l'Univers, 100'000 ans après le Big Bang.
On distingue les molécules inorganiques des molécules organiques, ces dernières étant principalement constituées de carbone et d'hydrogène. Il en existe près de dix millions, soit plus de vingt-cinq fois le nombre de molécules inorganiques.
| Tous les éléments naturels du tableau périodique – y compris les gaz inertes, ainsi que plusieurs éléments synthétiques transuraniens –, sont capables de se combiner avec d'autres pour former des molécules. (Source : alloprof) |
Les liaisons chimiques
C'est gr âce aux liaisons chimiques que les atomes se lient entre eux pour former des molécules. Une liaison chimique est une interaction entre plusieurs atomes, ions ou molécules, à une distance permettant la stabilisation du système et la formation d'une substance chimique. L'interaction est due le plus souvent à un partage d'électrons entre les atomes.
Il existe différents types de liaisons chimiques. Elles peuvent être ioniques, covalentes, métalliques, etc. Le type de liaison dépend de la distribution des orbitales dans les atomes constituant la molécule, ainsi que de la différence de leur électronégativité. De nombreux modèles existent pour les décrire. Les plus connus sont le modèle de Lewis et la théorie des orbitales moléculaires.
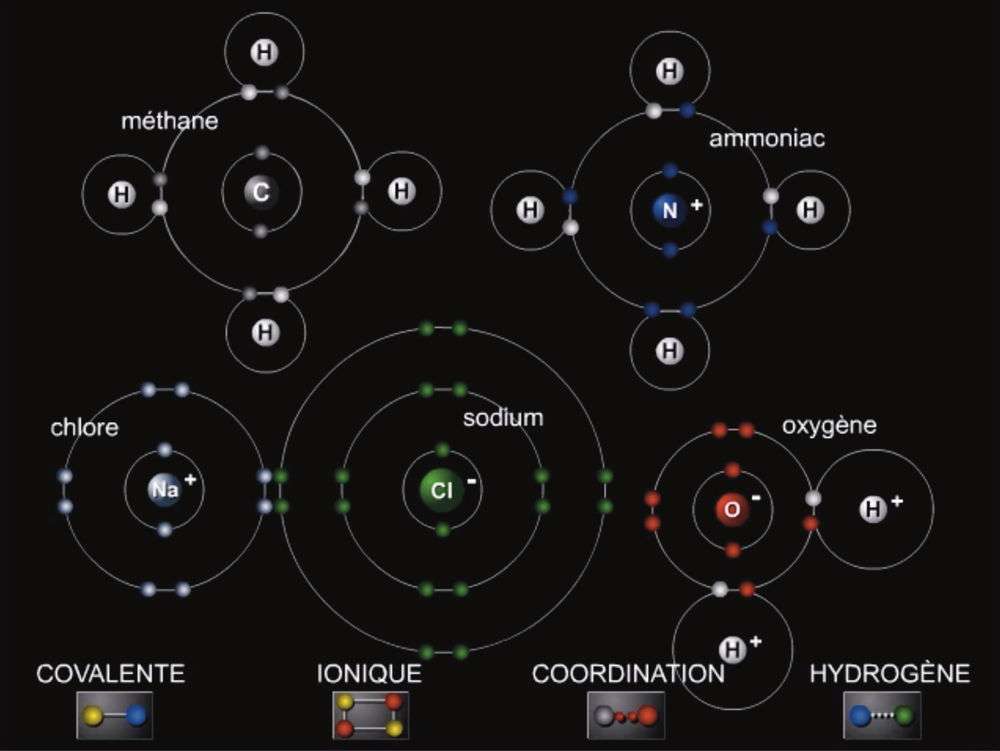
| Il existe plusieurs types de liaisons chimiques. (Source : Larousse) |
La liaison covalente
Dans la liaison covalente, deux atomes mettent en commun deux électrons de leur couche externe, pour former un doublet les reliant. Les deux électrons peuvent venir du même atome ou de chacun d'entre eux. La paire d'électrons est délocalisée entre les deux atomes, si bien qu'il y a recouvrement des orbitales atomiques. La mise en commun de deux ou trois paires d'électrons forme des liaisons respectivement doubles et triples.
La liaison covalente est caractéristiques des molécules de la chimie organique, ainsi que des non-métaux, lorsque la différence d'électronégativité est inférieure à 1,7 sur l'échelle de Pauling. Au-delà de cette valeur, l'interaction est dite ionique.
Une liaison covalente peut être simple, double ou triple. Les liaisons simples comportent deux électrons partagés, les liaisons doubles en comportent quatre et les liaisons triples en ont six. Dans le modèle de Lewis, ces liaisons sont représentées respectivement par un, deux ou trois traits. Exemple : Cl-Cl (chlore), C=O (oxyde de carbone), HC;CH (acétylène).
Lorsque les deux électrons partagés dans la liaison proviennent du même atome, la liaison est dite « covalente de coordination ».
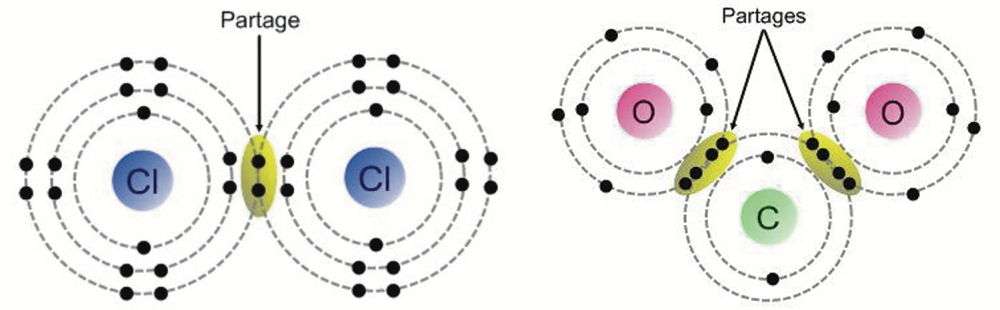
| Dans la liaison covalente, deux atomes mettent en commun deux électrons de leur couche externe, pour former un doublet les reliant. Ici, les molécules de chlore (Cl2) et de dioxyde de carbone (CO2). (Source : alloprof) |
La liaison ionique
La liaison ionique ou électrovalence est une interaction électrostatique entre ions au sein d'un cristal. Elle est constituée d'une paire d'atomes ou de groupes d'atomes possédant une différence d'électronégativité supérieure à 1,7, typiquement entre un non-métal et un métal. Le métal donne un ou plusieurs électrons, formant ainsi un ion chargé positivement (cation). Le non-métal capte ces électrons pour former un ion chargé négativement (anion). La liaison résulte de l'attraction entre le cation et l'anion.
Dans le sel de cuisine, par exemple (NaCl), l'atome de sodium, qui n'a qu'un seul électron périphérique, le perd en formant l'ion Na+. Cet ion est capté par l'atome de chlore, auquel il manque un électron sur sa couche périphérique, formant ainsi l'anion Cl-. Les ions Na+ et Cl- se lient l'un à l'autre par une force d'attraction électrostatique pour former la molécule NaCl.
Des interactions entre ions polyatomiques peuvent également s'exercer, comme lors de la réaction de formation du nitrate d'ammonium à partir d'ammoniac et d'acide nitrique, par exemple : NH4+ + NO3- → NH4NO3.
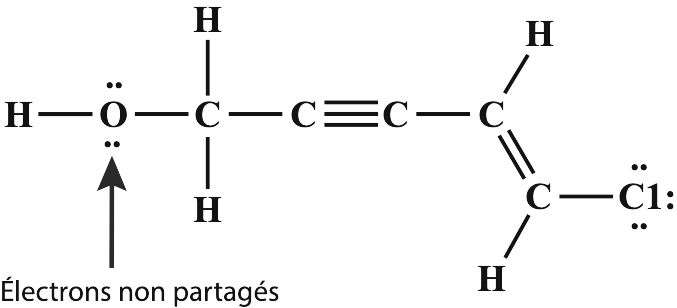
| Une liaison covalente peut être simple, double ou triple. Les liaisons simples comportent deux électrons partagés, les liaisons doubles en comportent quatre et les liaisons triples en ont six. |
La liaison hydrogène
La liaison hydrogène ou pont hydrogène est une liaison de faible intensité. Elle met en Å“uvre un atome d'hydrogène et un atome électronégatif, le plus souvent l'oxygène, mais aussi l'azote ou un halogène. L'intensité de la liaison hydrogène est intermédiaire entre celle d'une liaison covalente et celle des forces de van der Waals.
La molécule d'eau est un exemple typique de liaison hydrogène. C'est elle qui permet d'expliquer les propriétés physiques exceptionnelles de l'eau, comme son point de fusion et son point d'ébullition anormalement élevés par rapport à des molécules ressemblantes, comme CH4, par exemple, dont le point de fusion est de -182 °C et le point d'ébullition de -161,5 °C. Ce sont également les liaisons hydrogène qui permettent d'expliquer la structure tétraédrique de l'eau et de la glace et pourquoi celle-ci a une densité inférieure à celle de l'eau.
Ce sont aussi les liaisons hydrogène qui confèrent leurs propriétés de résistance exceptionnelle aux chaînes de polymères, comme le poly-para-phénylènetéréphtalamide (PPD-T), commercialisé sous le nom de Kevlar.
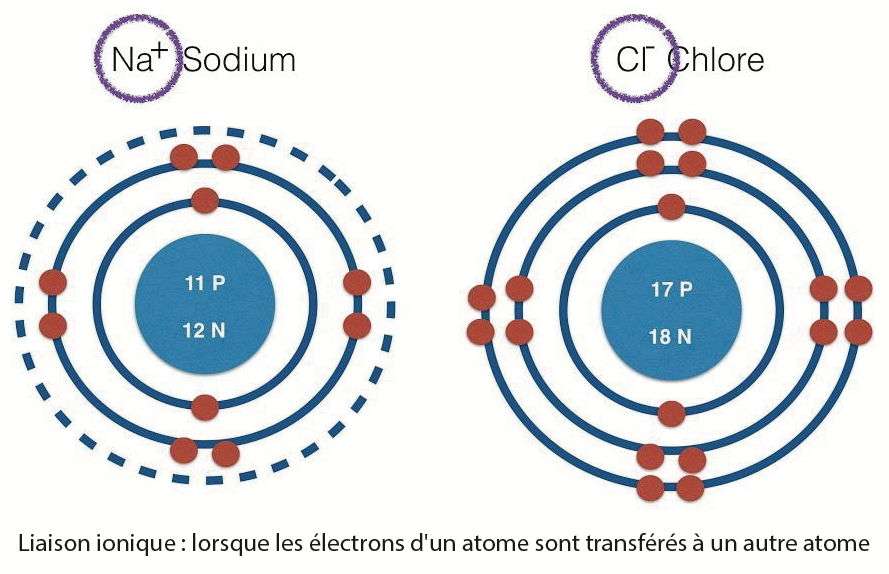
| La liaison ionique est une interaction électrostatique entre ions au sein d'un cristal. |
La liaison halogène
La liaison halogène est une liaison de faible intensité qui peut se former entre un atome d'halogène (fluor, chlore, brome, iode) déficient en électrons (appelé acide de Lewis) et un autre atome riche en électrons, comme l'oxygène, l'azote ou le soufre (base de Lewis). Ce type de liaison est fréquent en biochimie.
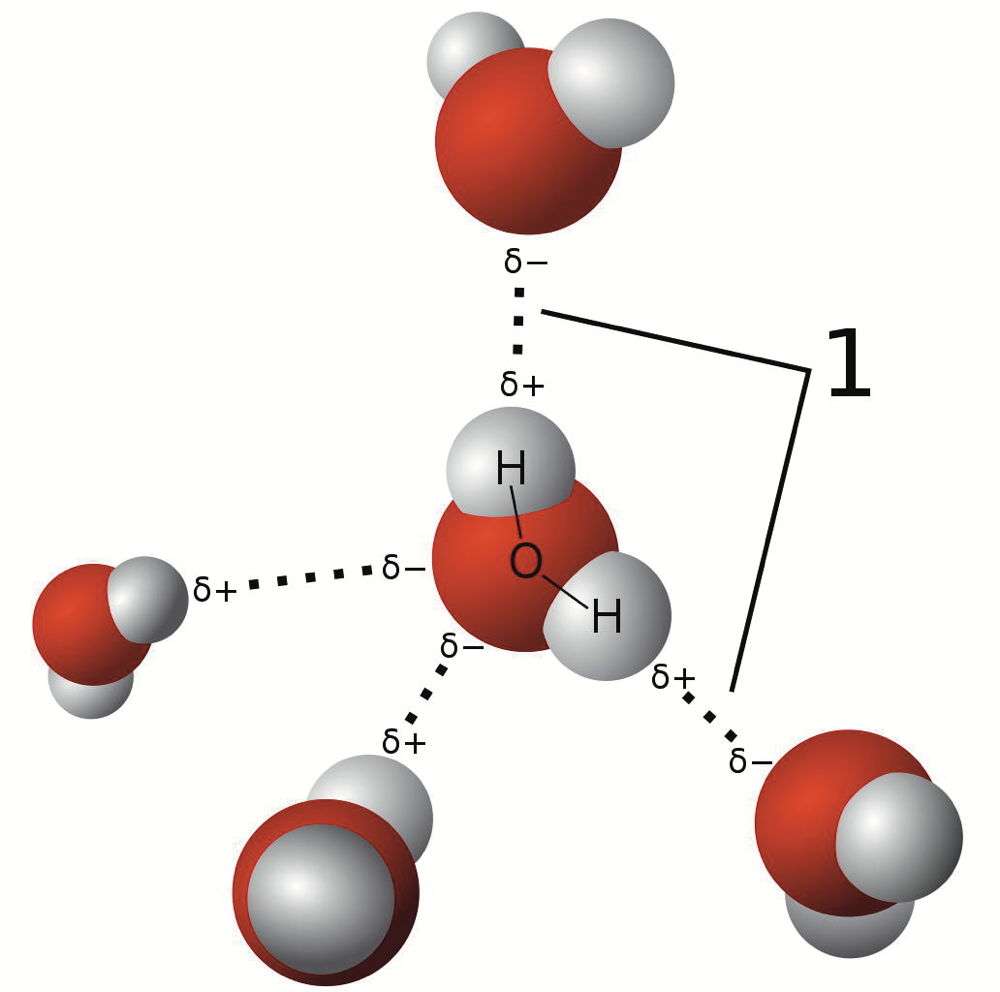
| Les liaisons hydrogène (1) relient entre elles les molécules d'eau, ce qui permet d'expliquer les points de fusion et d'ébullition anormalement élevés de cet élément. |
La liaison π
La liaison Ï€ est une liaison covalente créée entre deux atomes par recouvrement d'orbitales de nombre quantique secondaire supérieur à 1 (orbitales p, d…). Elle est présente notamment dans les alcènes (hydrocarbures ayant une double liaison, comme l'éthylène, par exemple) et les alcynes (hydrocarbures présentant une triple liaison, comme l'acétylène).
La liaison Ï€ permet les réactions d'addition, au cours desquelles une liaison Ï€ est supprimée par la création de deux liaisons covalentes. Elle est caractéristique des hydrocarbures aromatiques, comme le benzène, par exemple, dans lequel les électrons sont délocalisés.
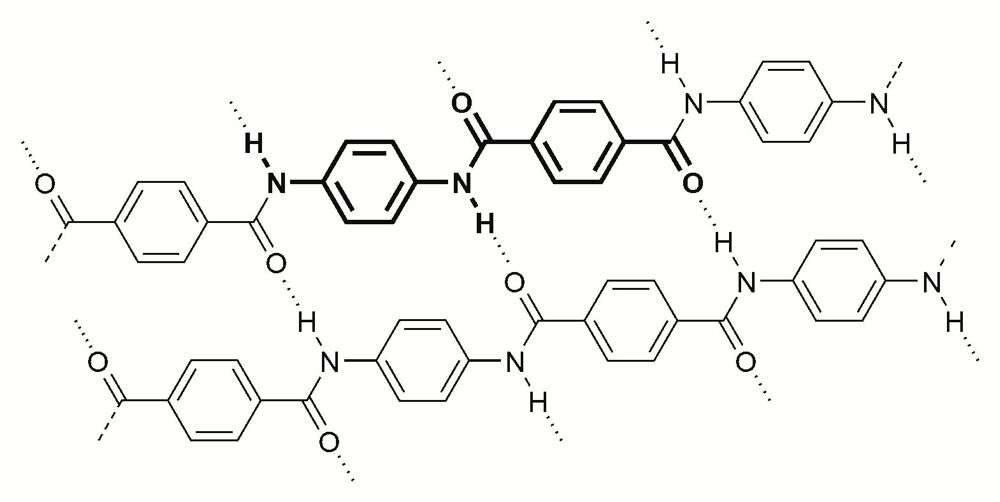
| Liaisons hydrogène entre les molécules du polymère Kevlar. |
La liaison de van der Waals
La liaison de van der Waals est une liaison de faible intensité, due aux interactions entre les moments dipolaires de deux atomes ou molécules. Elle n'est pas une véritable liaison chimique, en ce sens que les électrons restent liés à leurs atomes ou molécules respectifs. À l'origine du terme de pression négative intervenant en correctif dans l'équation des gaz parfaits, les liaisons de van der Waals sont essentielles pour appréhender les forces entre les atomes des gaz inertes.

| Dans les métaux, les électrons de la couche périphérique se déplacent librement dans l'édifice cristallin. D'où leur nom d'électrons libres.(© Shutterstock) |
La liaison métallique
Plus faibles que les liaisons ioniques et les liaisons covalentes, les liaisons métalliques interviennent, comme leur nom l'indique, entre les atomes qui constituent les métaux, qu'il s'agisse de corps simples ou d'alliages. Dans les métaux, en raison de leur de structure cristalline, les électrons situés sur la couche périphérique se déplacent dans l'édifice cristallin, en mouvement constant et désordonné. D'où leur nom d'électrons libres.
La liaison métallique permet d'expliquer certaines propriétés physiques des métaux, notamment leur conductivité électrique et thermique, leur brillance – les électrons libres favorisant la propagation des photons dans le matériau –, leur ductilité et leur malléabilité –, la présence d'électrons libres permettant d'éviter de trop fortes répulsions entre cations –, ainsi que leurs points de fusion et d'ébullition plus élevés que ceux des non-métaux, en renforçant les autres types de liaisons interatomiques, notamment les liaisons covalentes de coordination, responsables des différentes structures cristallines (cubique, hexagonale, etc.). La force d'une liaison métallique dépend du nombre d'électrons libres par atome du métal.
Le modèle le plus simple considère que le métal est constitué non pas d'atomes, mais de cations ayant mis en commun chacun un électron. C'est cette mise en commun, avec une délocalisation sur tout le cristal, qui rend compte de sa stabilité.
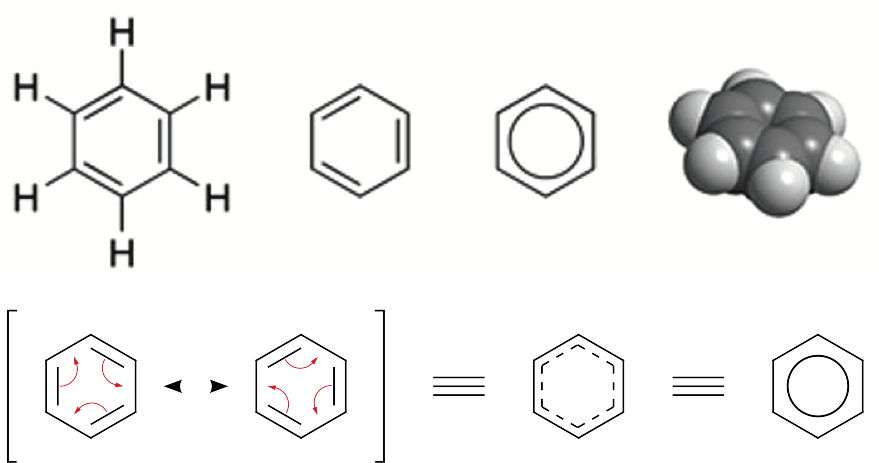
| La représentation mésomérique de l'atome de benzène. |
La mésomérie
La mésomérie est un terme qui désigne la délocalisation d'électrons dans les molécules, celles de la chimie organique aromatique, notamment. Il s'agit d'une représentation simplifiée des systèmes moléculaires, qui sont plus précisément décrits par des approches de chimie quantique.
Le benzène est l'exemple typique de mésomérie. Ce composé organique de formule brute C6H6, appartient à la famille des hydrocarbures aromatiques. Sa molécule est constituée de six atomes d'hydrogène, de six atomes de carbone et de six électrons délocalisés, formant un hexagone comportant six liaisons identiques entre les atomes de carbone, et non pas une alternance de liaisons doubles et de liaisons simples. En effet, la longueur des liaisons C—C, mesurée expérimentalement, est intermédiaire entre celles d'une liaison simple et d'une liaison double. C'est pourquoi on représente le benzène, tout comme ses dérivés, par un hexagone contenant un cercle ou des pointillés.
Les radicaux libres
Les radicaux libres sont des molécules possédant un ou plusieurs électrons non appariés sur leur couche externe. Ces électrons célibataires leur confèrent une grande instabilité, si bien que leur durée de vie est très courte, car elles sont très réactives et vont récupérer des électrons sur d'autres molécules.
Les radicaux sont généralement obtenus par rupture d'une liaison chimique, lors de la combustion de carburants, par exemple. On en trouve notamment dans le milieu interstellaire, où la probabilité de rencontre entre atomes est très faible.
|
L'Union internationale de chimie pure et appliquée
Créée en 1919, l'Union internationale de chimie pure et appliquée (UICPA) est une ONG dont le siège est à Zurich. Elle s'intéresse aux progrès dans les domaines de la chimie et des disciplines apparentées (chimie physique, biochimie, etc.). Elle a pour membres des sociétés nationales de chimie.
L'UICPA est l'autorité reconnue pour le développement des règles à adopter concernant la nomenclature, les symboles et la terminologie des éléments chimiques et de leurs dérivés, par le biais de son Comité interdivisionnel de la nomenclature et des symboles. Elle est membre du Conseil international pour la science.
www.iupac.org |
|
L'électronégativité
L'électronégativité d'un atome est un paramètre physique qui caractérise sa capacité à attirer les électrons lors de la formation d'une liaison avec un autre élément. La différence d'électronégativité entre les deux éléments détermine la nature de la liaison : covalente lorsque la différence d'électronégativité est inférieure à 1,7 sur l'échelle de Pauling, apolaire lorsque la différence est nulle ou faible, polaire quand la différence est moyenne, et ionique quand elle est forte et que les atomes deviennent des ions portant des charges électriques entières.
L'échelle de Pauling est une mesure de l'électronégativité dans laquelle l'élément le plus électronégatif, le fluor, a une valeur de 4 et l'élément le moins électronégatif, le francium, une valeur de 0,7. Les valeurs des éléments de la deuxième période du tableau périodique sont des multiples de 0,5. Li: 1; Be: 1,5; B: 2; C: 2,5; N: 3; O: 3,5; F: 4. |
|
Le modèle de Lewis
Le modèle de Lewis est une représentation simplifiée en deux dimensions de la structure électronique externe des atomes composant une molécule. Il permet d'expliquer la composition et la réactivité de nombreux composés, en définissant la localisation des électrons sur ou entre les atomes de la molécule. Seuls les électrons de la couche externe sont pris en compte. On obtient ainsi une vision de la structure électronique de la molécule par ses doublets libres, ses doublets liants (liaisons Ï€), ses lacunes et, dans le cas des radicaux, ses électrons célibataires.
|
|
La théorie des orbitales moléculaires
La théorie des orbitales moléculaires est une méthode permettant de déterminer la structure moléculaire dans laquelle les électrons ne sont pas assignés à des liaisons chimiques spécifiques entre les atomes, mais sont traités comme se déplaçant sous l'influence des noyaux de la molécule, chaque molécule étant dotée d'un ensemble d'orbitales moléculaires.
En chimie quantique, une orbitale moléculaire est une fonction mathématique décrivant le comportement ondulatoire d'un électron dans la molécule. Elle permet de calculer la configuration électronique des molécules, la distribution spatiale et énergétique des électrons, et d'en déduire des propriétés physiques et chimiques.
|






 Subscriptions
Subscriptions









