Les alternatives possibles aux batteries lithium-ion
La demande de batteries pour stocker les énergies renouvelables est en pleine croissance. Existe-t-il des alternatives aux batteries lithium-ion qui impactent moins l’environnement et préservent mieux nos ressources ? Deux chercheurs de l’Empa et de l’EPFZ ont examiné de plus près les possibilités.

Les batteries de stockage doivent être bon marché et leur fabrication présenter peu d’impact sur l’environnement. Taille et poids sont en revanche d’importance secondaire. (Image : iStock)
L’économie mondiale exige de plus en plus de batteries lithium-ion. Les voitures électriques en dépendent, tout comme les ordinateurs portables, les smartphones et les outils électriques destinés aux secteurs de la construction et du bricolage. Bientôt, un autre domaine qui nécessite des batteries rechargeables à grande échelle émergera : le stockage de l’énergie renouvelable qui ne peut pas être utilisée directement.
Les quantités croissantes d’électricité verte temporairement disponibles ne peuvent plus être stockées dans les seules centrales à pompage-turbinage, car le réseau électrique surchargé ne le permet guère. La demande de batteries stationnaires à faible coût va donc augmenter fortement. Elles doivent également être fabriquées, dans la mesure du possible, à partir de matériaux respectueux de l’environnement, afin de ne pas épuiser davantage les réserves mondiales de lithium et de cobalt, métaux contenus dans les batteries lithium-ion.
Kostiantyn Kravchyk et Maksym Kovalenko, des chercheurs de l’Empa et de l’EPF de Zurich, ont examiné de plus près les alternatives possibles aux batteries lithium-ion. Ils ont étudié des dizaines de publications de groupes de recherche du monde entier et ont systématiquement mené leurs propres expériences. Leurs évaluations ont été publiées au début de l’année dans le New Journal of Chemistry.
Le sodium : moins de cycles de charge
L’une des idées les plus simples serait de remplacer le lithium par le sodium, un métal dont les sels sont très abondant dans la nature. Le chlorure de sodium, qui se trouve dans l’eau de mer, est accessible partout dans le monde. Mais les avantages sont limités. Comme un ion sodium est environ 50 % plus volumineux qu’un ion lithium, les matériaux de la cathode sont électrochimiquement moins stables. L’oxyde de sodium-cobalt, par exemple, qui correspond à l’oxyde de lithium-cobalt d’une batterie lithium-ion standard, peut supporter beaucoup moins de cycles de charge. Cela élimine l’idée d’un coût avantageux. Il y a également des problèmes avec le matériau de l’anode. Le graphite utilisé dans les batterie lithium-ion est inutile dans les batteries au sodium, car il stocke trop peu d’ions de ce métal.
L’étain, l’antimoine et le phosphore : problème de gonflement
Des expériences avec l’étain, l’antimoine ou le phosphore ont montré de bons résultats dans le stockage des charges électriques, mais lors de la charge, l’anode gonfle jusqu’à trois fois son volume d’origine. Cela nuit à la stabilité mécanique. En cas de choc, le matériau gonflé peut se désintégrer et endommager la batterie. Avec les anodes de phosphore, il y a un problème encore plus grave. Lors de la charge, du phosphure de sodium (Na3P7) se forme dans l’anode, qui réagit avec l’eau pour produire du monophosphane, un gaz extrêmement toxique. Les phosphures métalliques utilisés comme raticide agissent de la même manière.
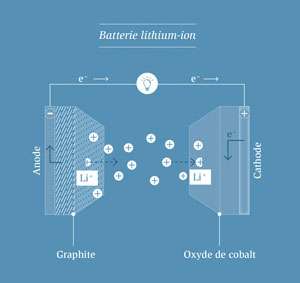
Lorsque la batterie est déchargée, des ions lithium sont libérés de l’anode en graphique, migrent vers la cathode et sont incorporés dans le réseau cristallin d’oxyde de cobalt. Lors de la charge, le processus est inversé (principe de la bascule).
Le magnésium : plage de tension réduite
Le magnésium suit le sodium dans le tableau périodique des éléments. Bon marché et non toxique, ce métal léger peut transférer deux électrons. Pourrait-on l’utiliser pour fabriquer des piles ? Du côté de l’anode, le magnésium présente en effet des avantages. On n’a pas besoin de graphite, mais on peut utiliser directement du magnésium métallique comme anode.
Toutefois, ce petit ion présente des inconvénients du côté de la cathode. La charge électrique élevée sur un petit diamètre entraîne des forces d’attraction électrique élevées. Beaucoup d’énergie est nécessaire pour le glisser dans un réseau d’oxyde de cobalt et s’il y est coincé, il est difficile de le faire ressortir. Si pour le faire, on utilise des tensions plus élevées, on risque de déclencher des processus d’oxydoréduction des composants de la batterie, et donc de les détruire. Ces piles ne se chargent donc pas rapidement et ne peuvent être utilisées que dans une plage de tension réduite, si elles doivent durer longtemps.
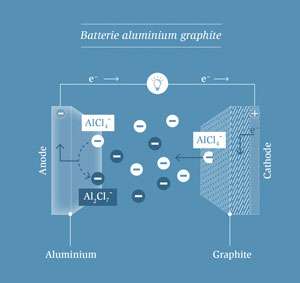
Lors de la décharge, le chlorure d’aluminium (AlCl4-) est converti en (Al2Cl7-) à l’anode et est libéré du graphite à la cathode. Le processus est inversé lors de la charge. Pour pouvoir recharger complètement la batterie, il faut disposer d’une quantité suffisante d’AlCl4-. Il faut donc beaucoup d’électrolyte. C’est pourquoi les piles à l’aluminium sont près de cinq fois plus lourdes que les piles lithium-ion.
L’aluminium : problème de migration des ions et de poids
Le métal suivant dans le tableau périodique est l’aluminium. Également disponible en grandes quantités, non toxique et bon marché, il peut transférer trois électrons. Comme la pile au magnésium, l’anode est facile à fabriquer ; une feuille d’aluminium suffit. Cependant, une batterie en aluminium fonctionne de manière fondamentalement différente d’une batterie lithium-ion, Dans celle-ci, lors de la décharge, selon le principe de la bascule, les ions de lithium se déplacent de l’anode à la cathode et ils y reviennent lors de la charge.
En revanche, dans une pile en aluminium, les ions de ce métal ne migrent pas directement entre l’anode et la cathode. Au lieu de cela, les composants de l’électrolyte sont « consommés » par les deux électrodes pendant la charge. D’une part, l’électrolyte fournit de l’aluminium, qui se dépose sur l’anode sous forme métallique. De l’autre côté de la batterie, les ions AlCl4- sont extraits de l’électrolyte et se déposent sur l’anode en graphite. La quantité d’électrolyte disponible est donc déterminante pour la capacité de la batterie.
En raison de ce principe de fonctionnement, une batterie aluminium-graphite sera toujours près de cinq fois plus lourde qu’une batterie lithium-ion comparable. Et il y a un autre problème : la cathode en graphite se dilate jusqu’à plus de deux fois son volume initial lors de chaque processus de charge et se contracte à nouveau lorsqu’elle est déchargée. Cela signifie que ces piles ont besoin d’une enveloppe extérieure souple et d’un boîtier de protection offrant suffisamment d’espace pour « respirer ». Le gonflement et le rétrécissement ont un effet négatif sur la résistance aux vibrations et sur la stabilité à long terme. De nouvelles conceptions sont donc nécessaires dans ce domaine.

Kostiantyn Kravchyk explique la chimie des batteries aluminium-graphite. Avec le graphite idoine, elles présentent des arêtes semblables à celles d’une rame de papier. Les ions chlorure d’aluminium y pénètrent aisément. Avec un moins bon graphite, les arêtes sont froissées. (Image : Empa)
Nouvelle système de gestion des batteries
L’algorithme de charge des batteries autres que celles au lithium-ion constitue un défi supplémentaire. Le groupe de recherche dirigé par Kostiantyn Kravchyk et Maksym Kovalenko a découvert que la performance d’une batterie aluminium-graphite pouvait être augmentée jusqu’à 25 % grâce à une charge intelligente et progressive. Un groupe de recherche travaillant à Taïwan, en Chine, aux États-Unis et en Allemagne a découvert que ces électrodes sont nettement plus efficaces lorsqu’elles sont refroidies à –10 °C.
Ces résultats montrent clairement qu’un nouveau système de gestion des batteries, c’est-à-dire de nouveaux capteurs, chargeurs et algorithmes, doit être mis au point pour des batteries dont la chimie est complètement différente. On ne sait pas encore très bien laquelle des technologies précitées prévaudra et pourra remplacer les batteries lithium-ion dans certains domaines.
Dans leur analyse, les chercheurs soulignent également qu’aucune des technologies présentées ne peut rivaliser avec les batteries lithium-ion en termes de densité d’énergie. Il est très probable que cela restera le cas à l’avenir. Ces piles alternatives ne sont donc concevables que pour des applications dans lesquelles l’électricité doit être stockée à un coût aussi bas que possible et où l’accent est mis sur une production écologique de piles.
Une recherche orientée vers les applications
Il reste donc beaucoup à faire pour les groupes de recherche du monde entier avant que les piles alternatives fassent une percée. Kostiantyn Kravchyk et Maksym Kovalenko souhaitent une approche plus holistique. « Dans le monde de la recherche, une expérience ne fait souvent que prouver la faisabilité d’une idée. Le coût des composants et le poids total du système, en revanche, sont souvent négligés », explique Kostiantyn Kravchyk. Mais ce sont précisément ces paramètres qui sont décisifs pour une éventuelle commercialisation. Ils devraient donc être davantage pris en compte dans les travaux de recherche.
Malgré cette étude quelque peu décevante, Kostiantyn Kravchyk continuera à l’avenir à faire des recherches sur les batteries alternatives. « Les systèmes utilisant le graphite comme cathode continueront d’être très intéressants. Nous avons déjà pu montrer que le gonflement et le rétrécissement du matériau de la cathode est également un problème qui peut être surmonté », déclare-t-il. Avec ses collègues, il fait actuellement des recherches sur des électrodes en graphite semi-solide, qui sont durables et peuvent bien transférer l’électricité.
Bibliographie
M. Walter, MV. Kovalenko, KV. Kravchyk ; Challenges and benefits of post-lithium-ion batteries ; New J Chem (2020) ; DOI : 10.1039/C9NJ05682C
KV. Kravchyk, MV. Kovalenko; Rechargeable Dual‐Ion Batteries with Graphite as a Cathode: Key Challenges and Opportunities; Adv Energy Mater (2019); DOI : 10.1002/aenm.201901749


 Des abonnements
Des abonnements




